 鄭財木助理教授陽明大學生化所碩士,交通大學生物科技系博士。博士畢業後在交通大學進行博士後研究,2009至2011年初在加拿大渥太華的「國家科學委員會」(National Research Council, NRC),從事抗體工程研究。2012年任教臺北醫學大學轉譯醫學博士學位學程。(編按)
鄭財木助理教授陽明大學生化所碩士,交通大學生物科技系博士。博士畢業後在交通大學進行博士後研究,2009至2011年初在加拿大渥太華的「國家科學委員會」(National Research Council, NRC),從事抗體工程研究。2012年任教臺北醫學大學轉譯醫學博士學位學程。(編按)
 生物體內所存在的免疫球蛋白(Immunoglobulin G, IgG),通常都以兩條重鏈(heavy chain)與兩條輕鏈 (light chain)的型態組成。1993年,Hamers-Casterman等人在駱駝科動物發現,牠們的血清中含有少量不存在輕鏈的抗體,此抗體稱作重鏈抗體(heavy-chain antibody, HCAb)。相較於正常抗體,因為少了第一段固定區(constant domain 1, CH1),故其分子量較小。【圖:鄭財木老師(中)與實驗室成員合影】
生物體內所存在的免疫球蛋白(Immunoglobulin G, IgG),通常都以兩條重鏈(heavy chain)與兩條輕鏈 (light chain)的型態組成。1993年,Hamers-Casterman等人在駱駝科動物發現,牠們的血清中含有少量不存在輕鏈的抗體,此抗體稱作重鏈抗體(heavy-chain antibody, HCAb)。相較於正常抗體,因為少了第一段固定區(constant domain 1, CH1),故其分子量較小。【圖:鄭財木老師(中)與實驗室成員合影】
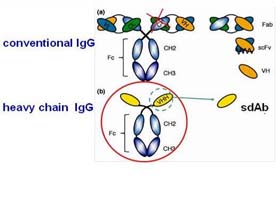 在輕鏈缺乏的狀況下,重鏈抗體以單一區域的形式結合至其抗原,此區域為重鏈免疫球蛋白的變異區(variable domain of heavy chain),被稱作VHH,有別於一般免疫球蛋白的變異區(variable domain , VH)。因此,來自single-domain VHH(或稱單域抗體: single domain Ab, sdAb)之有功能的免疫球蛋白為最小抗體具有完整結合於抗原之能力。2000年,Nguyen, Vu與Harmsen等人首次由cDNA中建構(clone)得到只有14 kDa的單域抗體(single-domain antibody, sdAb),能在大腸桿菌中表現完整功能的單域抗體。【圖:單域抗體的結構】
在輕鏈缺乏的狀況下,重鏈抗體以單一區域的形式結合至其抗原,此區域為重鏈免疫球蛋白的變異區(variable domain of heavy chain),被稱作VHH,有別於一般免疫球蛋白的變異區(variable domain , VH)。因此,來自single-domain VHH(或稱單域抗體: single domain Ab, sdAb)之有功能的免疫球蛋白為最小抗體具有完整結合於抗原之能力。2000年,Nguyen, Vu與Harmsen等人首次由cDNA中建構(clone)得到只有14 kDa的單域抗體(single-domain antibody, sdAb),能在大腸桿菌中表現完整功能的單域抗體。【圖:單域抗體的結構】
目前實驗室已自南美洲駱馬(llama)建構了抗人類「癌胚抗原相關細胞黏附分子6」(Carcinoembryonic Antigen Related Cell Adhesion Molecule 6, CEACAM6)具有高溶解度(high solubility)、良好的熱穩定性(thermal stability)、極佳的再折疊能力(refolding capacity)、耐酸鹼能力佳(pH4~pH9)、結構穩定(conformational stability)等特性,且分子小,易於穿透組織,只需短時間(數分鐘)即可到達標的位置。
實驗室建構的抗CEACAM6單域抗體,發表在《歐洲癌症雜誌》(Eur J Cancer, 2014; 50:713-21)的成果證實,能抑制胰臟癌細胞BxPC3的增生(proliferation)、遷移(migration)、侵襲(invasion)及血管新生(angiogenesis),進而抑制病人胰臟癌的進程。更進一步,實驗室在有表現CEACAM6表面抗原的乳癌、肺癌、及血癌細胞株都有相近的結果。
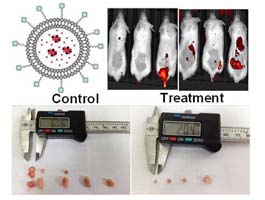 應用奈米技術將專一的anti-CEACAM6 sdAb結合包埋化療的藥物,可發展為新型癌症標靶治療藥物。我們已成功將anti-CEACAM6 sdAb接在包埋了發近紅外光cypate之poly(lactic-co-glycolic acid)(PLGA)的奈米載體上,在小鼠模式成功由光學影像追蹤到被標靶的人類乳癌細胞,並減小腫瘤的大小。在偵測到癌細胞的同時,抗體已針對癌細胞進行治療,達到診療一體(Theranostic)之功。進一步,可針對不同癌症的特殊表現標記(specific cancer markers),進行不同癌症的診斷並同時治療的「診療一體」臨床應用研究。【圖:診療一體的奈米載體,及其在小鼠模式上,人類乳癌診斷並治療的應用】
應用奈米技術將專一的anti-CEACAM6 sdAb結合包埋化療的藥物,可發展為新型癌症標靶治療藥物。我們已成功將anti-CEACAM6 sdAb接在包埋了發近紅外光cypate之poly(lactic-co-glycolic acid)(PLGA)的奈米載體上,在小鼠模式成功由光學影像追蹤到被標靶的人類乳癌細胞,並減小腫瘤的大小。在偵測到癌細胞的同時,抗體已針對癌細胞進行治療,達到診療一體(Theranostic)之功。進一步,可針對不同癌症的特殊表現標記(specific cancer markers),進行不同癌症的診斷並同時治療的「診療一體」臨床應用研究。【圖:診療一體的奈米載體,及其在小鼠模式上,人類乳癌診斷並治療的應用】
在閻校長的領軍之下,整合此技術的研究發展,獲得科技部3年期(104~106)的國家奈米主軸計畫支持,第1年核撥9百萬臺幣補助。以發展對急性髓細胞性白血病和白血病幹細胞能診療一貫的奈米標靶藥物並臨床治療前評價。(文/鄭財木,醫學科技學院轉譯醫學博士學位學程助理教授)

