營養學院食品安全學系陳奕廷副教授及代謝與肥胖科學研究所張瀞文老師,分別發表論文於2023年11月的《Food Chemistry》及2023年10月的《Hepatology》,營養學院特在本刊分享他們的相關研究。
▓食品安全學系陳奕廷副教授:食品過敏原檢測—軟體動物免疫檢測法開發
食物過敏為全球性食品安全議題,相較於其他食安危害大多需要長時間的食用才會產生影響,食品過敏的反應卻十分迅速。食品過敏患者食用或接觸到食品過敏原(Food Allergen)後,通常會立刻產生過敏症狀,包括嘴唇腫漲、皮膚紅腫、呼吸困難等,甚至可能出現致命的過敏性休克。
未標示的食品過敏原可能在儲存、加工、運輸、烹煮等過程中摻入食品中,這些潛藏的食品過敏原不僅危害過敏族群的飲食安全,也是食品招回的主要原因,對於食品產業與公共醫療系統帶來沈重的負擔。
 目前的醫療仍然無法治癒食品過敏,只能降低過敏反應的不適。食品過敏患者主要依靠食品包裝上的食品過敏原資訊避開特定食品,以免誤食含特定過敏原的食品。為了保護食品過敏族群,主要的食品過敏原必須明確標示於食品外包裝。軟體動物像是常見的花枝、章魚、九孔、文蛤、生蠔等,是許多國家法規中強制性或建議性標示的食品過敏原。
目前的醫療仍然無法治癒食品過敏,只能降低過敏反應的不適。食品過敏患者主要依靠食品包裝上的食品過敏原資訊避開特定食品,以免誤食含特定過敏原的食品。為了保護食品過敏族群,主要的食品過敏原必須明確標示於食品外包裝。軟體動物像是常見的花枝、章魚、九孔、文蛤、生蠔等,是許多國家法規中強制性或建議性標示的食品過敏原。
在食品過敏原檢測中,免疫檢測法透過特定蛋白質作為檢測標的物進行檢測,已普遍用於食品產業的快篩檢測。然而,過去針對軟體動物的檢測方法面臨許多困境與限制,例如無法分辨甲殼類與軟體動物、可以檢測的物種有限、僅能檢測生鮮樣本等。為了保護食品過敏的族群,本校營養學院食品安全學系陳奕廷副教授實驗室獨力開發了檢測軟體動物的免疫檢測法(Sandwich ELISA)。【左圖:營養學院食品安全學系陳奕廷副教授】
此新開發的免疫檢測法具有物種專一性,可檢測32種常見食用軟體動物,包含頭足類(魷魚、花枝、章魚等)、腹足類(鮑魚、九孔、海螺等)、雙殼類(牡蠣、文蛤、扇貝等),並可檢測生鮮和加工後的樣本,包括清蒸、水煮、烘烤、油炸、高壓滅菌,對於乾燥、鹽漬、烘焙、罐頭等市售軟體動物加工食品皆能成功檢測,且此檢測法的各項能力均符合國際標準。此研究已於2023年11月發表於《Food Chemistry》(Impact Factor: 8.8, R/O=5.7%)
陳教授團隊預期所開發的Sandwich ELISA檢測方法,能轉為更加便利的快篩試劑形式,使民眾能即時檢測飲食中潛藏的軟體動物成分,降低食品過敏族群的飲食風險並落實食品過敏法規、維護食品安全。(文/營養學院)【下圖:軟體動物之Sandwich ELISA檢測原理】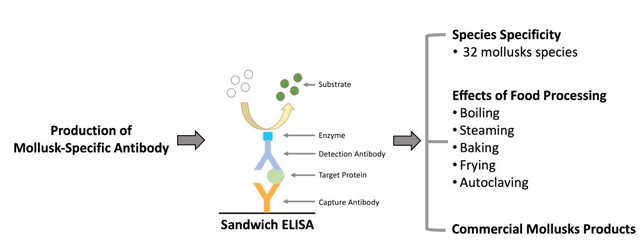
▓代謝與肥胖科學研究所張瀞文老師:與NIH聯合研究揭示肝病進展中的粒線體DNAJA3角色
臺北醫學大學營養學院代謝與肥胖科學研究所張瀞文助理教授,為代謝與肥胖科學研究所之新進教師,研究方向主要為脂肪肝之代謝調控相關議題。2018年~2023年間,於美國國家衛生研究院國家癌症研究所擔任博士後研究員,研究成果發表於多本SCI期刊,並榮獲2021年美國國家衛生研究院(NIH)女科學家顧問學者獎、2020年與2018年美國國家衛生研究院卓越研究獎競賽研究員獎。


張瀞文助理教授與陽明交通大學口腔生物研究所羅正汎特聘教授及美國國家癌症研究所(National Cancer Institute , NCI)高級研究員王心偉教授所共同進行的研究發現,粒線體中DNAJA3蛋白可能是非酒精性脂肪性肝炎(Nonalcoholic Steatohepatitis, NASH)進展為肝細胞癌(Hepatocellular Carcinoma, HCC)的一個遺傳風險因子。此國際聯合研究不僅加深了我們對肝病進展機制的理解,也為NASH相關肝細胞癌之治療開闢新的道路。【左圖:張瀞文老師(中)和駐美國臺北經濟文化代表處代表(左)及陽明交通大學羅正汎特聘教授(右)合影】【右圖:張瀞文老師(中)與美國國家衛生研究院王心偉教授(右)合影】
非酒精性脂肪肝疾病(Nonalcoholic Fatty Liver Disease, NAFLD)為過多脂肪堆積在肝臟中的病症,在臺灣盛行率為11.4%~41%,是目前全球最常見的慢性肝臟疾病。依據組織學又可以區分成「非酒精性脂肪肝」(Nonalcoholic Fatty Liver, NAFL)及「非酒精性脂肪肝炎」(NASH)。當其合併肥胖、第二型糖尿病或代謝失調的臨床證據,例如腰圍增加、血脂或血糖的異常等,即為代謝性脂肪肝病(metabolic-associated fatty liver disease, MAFLD)。
眾所皆知,長期未控制的非酒精性脂肪肝不僅會對肝臟造成傷害,也會造成慢性肝炎、肝硬化甚至於肝癌,在肝癌中又以肝細胞癌為成年人中最常見類型的慢性肝癌類型。目前已知肥胖、第2型糖尿病、血脂異常等代謝異常是代謝性脂肪肝病之主要風險因子。而先前研究亦顯示,同時合併代謝症候群相關代謝項目異常的NASH患者,具有較高的肝細胞癌罹患風險。因此,深入了解代謝功能障礙與NASH相關肝細胞癌發展間的相互作用,對於制定新的治療策略至關重要,但現有研究證據對於促使NAFLD到NASH,再到肝細胞癌進展的遺傳機制,仍未充分探明。
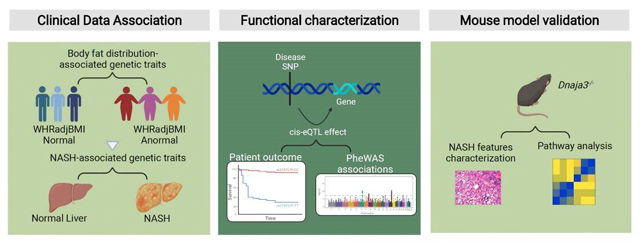
此研究首先透過人體實驗找到24組與體脂肪分布顯著相關的等位基因 (n=344,369)後,再與另外3個患有NAFLD/NASH/HCC美國與歐洲人之獨立世代研究(N=1,380)進行比對,透過全基因組關聯分析,鑑定出與NASH相關肝細胞癌有顯著關聯的rs3747579-TT變異,並確認其為DNAJA3基因的表現數量性狀基因座(Expression Quantitative Trait Loci, eQTL),更發現攜帶該變異的HCC患者呈現DNAJA3基因表現量下降與不良預後。此研究已於2023年10月發表於《Hepatology》(Impact Factor: 13.5, R/O=7.53%)
進一步透過DNAJA3基因缺失小鼠模型,發現了非酒精性脂肪肝病引起之肝細胞癌可能的分子病理機制,包含顯著的粒線體功能異常、小鼠肝臟內脂質過度蓄積和發炎反應的發生,而此發現對於理解NASH轉變為肝細胞癌的分子機轉具有重要突破,有助於提供未來對於肝癌防治的新方向。(文/營養學院)【下圖:於《Hepatology》刊載的非酒精性脂肪性肝炎相關肝細胞癌中粒線體DNAJA3的遺傳基礎】