 臺灣口腔癌發生率高居世界第一,晚期的癌細胞快速生長、轉移與復發總是讓醫師束手無策。不過,在臺北醫學大學、國家衛生研究院與奇美醫院共同合作的研究團隊努力下,領先全球成功發現一個在口腔癌細胞大量表現的長鏈非編碼RNA(LncHIFCAR, long noncoding HIF-1a co-activating RNA),正是啟動腫瘤缺氧反應的重要因子,也是促使口腔癌惡化轉移的致病關鍵,為癌症治療開啟新契機。
臺灣口腔癌發生率高居世界第一,晚期的癌細胞快速生長、轉移與復發總是讓醫師束手無策。不過,在臺北醫學大學、國家衛生研究院與奇美醫院共同合作的研究團隊努力下,領先全球成功發現一個在口腔癌細胞大量表現的長鏈非編碼RNA(LncHIFCAR, long noncoding HIF-1a co-activating RNA),正是啟動腫瘤缺氧反應的重要因子,也是促使口腔癌惡化轉移的致病關鍵,為癌症治療開啟新契機。
 該研究團隊成員包括國衛院前院長龔行健院士,偕同臺北醫學大學校長閻雲、醫學科技學院轉譯學程兼任助理教授施景文,與柳營奇美醫院牙醫部部長蔣維凡醫師等人組成跨領域合作的研究團隊。
該研究團隊成員包括國衛院前院長龔行健院士,偕同臺北醫學大學校長閻雲、醫學科技學院轉譯學程兼任助理教授施景文,與柳營奇美醫院牙醫部部長蔣維凡醫師等人組成跨領域合作的研究團隊。
結合基礎科學研究與奇美醫院生物資料庫檢體資源,獲得此一突破性研究成果,論文已刊登在2017年6月底出版的國際知名期刊《自然通訊》(Nature Communications),備受國際矚目。【右圖:研究團隊代表合影,左起奇美醫院蔣維凡部長、邱仲慶院長,以及閻雲校長、龔行健院士、施景文助理教授】

 依據衛生福利部公布資料顯示,臺灣口腔癌發生率高居世界第一,不僅是男性常見癌症排名第4位,甚至是30至59歲男性中癌症發生率的第一位,而此年齡層的男性往往已是社會之中堅,也是家庭生計之所依。因此,口腔癌的發生對於醫療支出與國家勞動力具莫大影響,更突顯出發展口腔癌早期診斷的生物標識以及有效治療之醫療策略的急迫性。【圖:閻雲校長(左圖)、龔行健院士(右圖)致辭及簡介研究成果】
依據衛生福利部公布資料顯示,臺灣口腔癌發生率高居世界第一,不僅是男性常見癌症排名第4位,甚至是30至59歲男性中癌症發生率的第一位,而此年齡層的男性往往已是社會之中堅,也是家庭生計之所依。因此,口腔癌的發生對於醫療支出與國家勞動力具莫大影響,更突顯出發展口腔癌早期診斷的生物標識以及有效治療之醫療策略的急迫性。【圖:閻雲校長(左圖)、龔行健院士(右圖)致辭及簡介研究成果】
 研究團隊解釋,癌症是種細胞不正常增生的多面向進展疾病,長久以來,癌症診療一直都是醫學界的棘手難題。特別是快速生長的晚期腫瘤,往往呈現抗藥性、抗放射性、快速轉移進而導致死亡。而近年來研究發現,許多腫瘤常因快速生長導致氧氣供應不足,內部呈現缺氧狀態。
研究團隊解釋,癌症是種細胞不正常增生的多面向進展疾病,長久以來,癌症診療一直都是醫學界的棘手難題。特別是快速生長的晚期腫瘤,往往呈現抗藥性、抗放射性、快速轉移進而導致死亡。而近年來研究發現,許多腫瘤常因快速生長導致氧氣供應不足,內部呈現缺氧狀態。
值得注意的是,缺氧環境是刺激癌細胞啟動一系列基因調控反應、進而引發腫瘤呈現快速生長、抗藥性與轉移進而惡化的微環境特徵,其中缺氧誘導因子(HIF-1α)在此缺氧反應中扮演舉足輕重的角色。【圖:奇美醫院邱仲慶院長致辭】
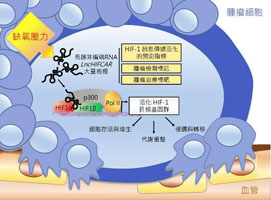 由於癌細胞在缺氧環境下,會活化「缺氧誘導因子HIF-1α」,促使其與許多輔助因子結合以形成完整的「HIF-1蛋白複合體」,進而啟動一系列缺氧反應相關基因群的表現,幫助腫瘤細胞於缺氧環境下存活,甚而促進癌細胞轉移、惡化與抗藥性。
由於癌細胞在缺氧環境下,會活化「缺氧誘導因子HIF-1α」,促使其與許多輔助因子結合以形成完整的「HIF-1蛋白複合體」,進而啟動一系列缺氧反應相關基因群的表現,幫助腫瘤細胞於缺氧環境下存活,甚而促進癌細胞轉移、惡化與抗藥性。
因此,深入了解腫瘤細胞調控缺氧反應的機轉,成為科學界與臨床醫學最迫切的課題。
【左圖:長鏈非編碼RNA LncHIFCAR與HIF-1α交互作用,及其在腫瘤形成與轉移過程所扮演的角色模型】

 研究團隊以長鏈非編碼RNA為主題,發現缺氧環境所誘發的長鏈非編碼RNA LncHIFCAR,可做為HIF-1α的輔助因子。施景文老師指出,LncHIFCAR在細胞遇到缺氧狀況時會大量表現,不僅會和HIF-1α直接結合,同時幫助其他轉錄輔助因子聚集形成HIF-1複合體,一起活化缺氧反應基因群的表現,進而協助腫瘤細胞在缺氧環境中調整代謝途徑、有效存活、快速增生,並促進腫瘤侵襲與轉移,造成癌症惡化。【圖:施景文老師(右圖)說明研究發現並回應問題】
研究團隊以長鏈非編碼RNA為主題,發現缺氧環境所誘發的長鏈非編碼RNA LncHIFCAR,可做為HIF-1α的輔助因子。施景文老師指出,LncHIFCAR在細胞遇到缺氧狀況時會大量表現,不僅會和HIF-1α直接結合,同時幫助其他轉錄輔助因子聚集形成HIF-1複合體,一起活化缺氧反應基因群的表現,進而協助腫瘤細胞在缺氧環境中調整代謝途徑、有效存活、快速增生,並促進腫瘤侵襲與轉移,造成癌症惡化。【圖:施景文老師(右圖)說明研究發現並回應問題】
研究成果發現,近年來大家普遍認為HIF-1複合體的組成,除了HIF-1α和其他蛋白質之外,尚有先前未知的RNA組成分子LncHIFCAR,並在整個HIF-1複合體之形成及癌細胞惡化的過程中扮演重要關鍵。研究團隊進一步指出,一旦少了LncHIFCAR,HIF-1複合體的活性就會下降,結構甚至崩解,癌細胞也會同時因此而死亡。

 研究團隊針對柳營奇美醫院所收集口腔癌患者的組織樣本進行分析,結果指出,相對於周邊的正常組織,腫瘤組織內的LncHIFCAR有大量表現的趨勢。進一步分析LncHIFCAR的表現,發現LncHIFCAR表現量高的口腔癌患者,3年內腫瘤復發與整體存活率均顯著較LncHIFCAR表現量低的口腔癌患者為差。生物統計分析更顯示,LncHIFCAR表現量可作為口腔癌患者腫瘤復發率的獨立預後指標,將可作為預測口腔癌復發轉移之嶄新生物標記。【圖:蔣維凡部長(右圖)回應現場提問】
研究團隊針對柳營奇美醫院所收集口腔癌患者的組織樣本進行分析,結果指出,相對於周邊的正常組織,腫瘤組織內的LncHIFCAR有大量表現的趨勢。進一步分析LncHIFCAR的表現,發現LncHIFCAR表現量高的口腔癌患者,3年內腫瘤復發與整體存活率均顯著較LncHIFCAR表現量低的口腔癌患者為差。生物統計分析更顯示,LncHIFCAR表現量可作為口腔癌患者腫瘤復發率的獨立預後指標,將可作為預測口腔癌復發轉移之嶄新生物標記。【圖:蔣維凡部長(右圖)回應現場提問】
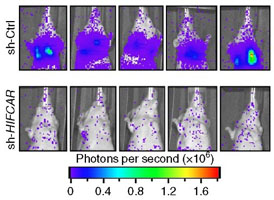 研究團隊另以動物模型進行實驗,分別將一般口腔癌細胞株與降低LncHIFCAR表現的口腔癌細胞株,經由尾部靜脈注射至小鼠體內。結果發現,降低LncHIFCAR表現的口腔癌細胞株轉移至小鼠肺部的能力顯著降低,進一步證實LncHIFCAR在腫瘤轉移的關鍵角色,以及其作為癌症治療標靶的深厚潛力。【左圖:分別將控制組的口腔癌細胞株(sh-Ctrl)與降低LncHIFCAR表現的口腔癌細胞株(sh-HIFCAR)經由尾部靜脈注射至小鼠體內。結果發現,降低LncHIFCAR表現的口腔癌細胞株轉移至小鼠肺部的能力顯著降低】
研究團隊另以動物模型進行實驗,分別將一般口腔癌細胞株與降低LncHIFCAR表現的口腔癌細胞株,經由尾部靜脈注射至小鼠體內。結果發現,降低LncHIFCAR表現的口腔癌細胞株轉移至小鼠肺部的能力顯著降低,進一步證實LncHIFCAR在腫瘤轉移的關鍵角色,以及其作為癌症治療標靶的深厚潛力。【左圖:分別將控制組的口腔癌細胞株(sh-Ctrl)與降低LncHIFCAR表現的口腔癌細胞株(sh-HIFCAR)經由尾部靜脈注射至小鼠體內。結果發現,降低LncHIFCAR表現的口腔癌細胞株轉移至小鼠肺部的能力顯著降低】
因此,今後除了可以LncHIFCAR為標的,設計更靈敏簡便的生物標記檢測套組,做為早期篩檢或預測口腔癌惡化及轉移的工具之外,更可進一步開發針對LncHIFCAR RNA專一性的阻斷性分子,透過微調LncHIFCAR RNA的表現量,作為具有高度惡化潛力口腔癌病患的精準治療方式,為未來癌症個人化醫療策略帶來嶄新的預測、診斷與治療方向。(文/醫學科技學院‧秘書處)

